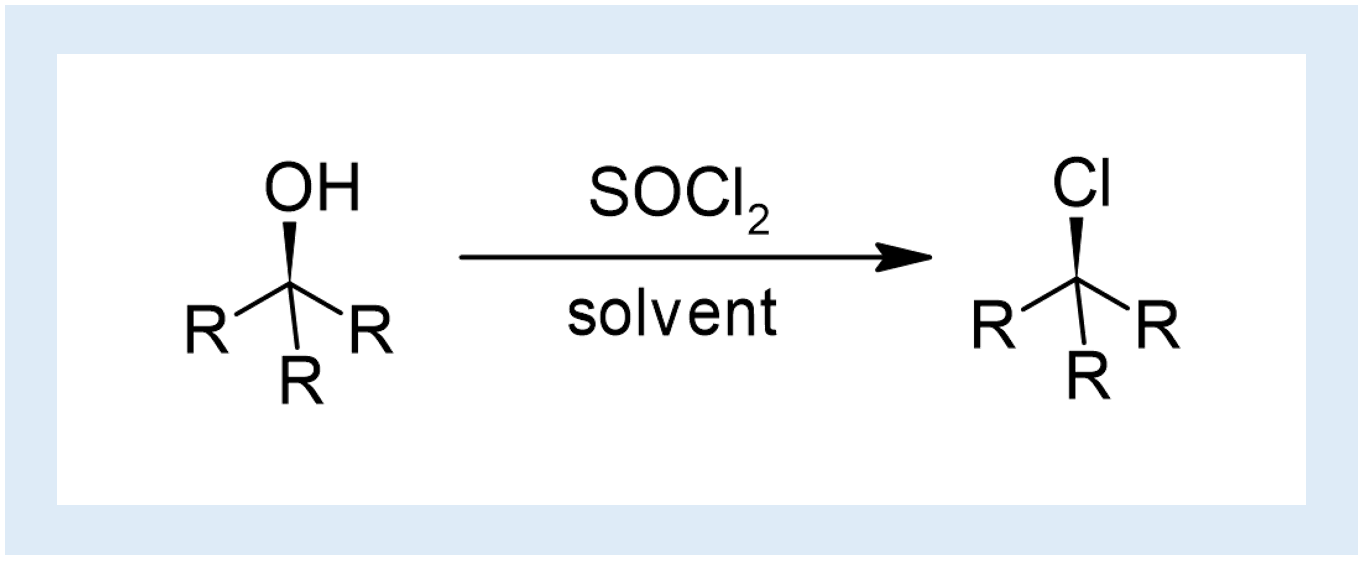
概要
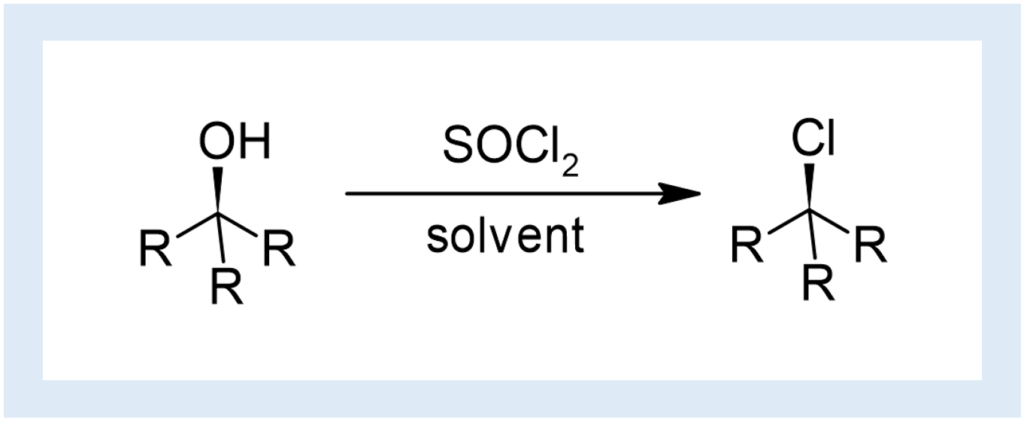
OHから塩化アルキルを得る手法の一つ。
同条件で塩化チオニルの代わりに臭化チオニルSOBr2を使うことで臭化アルキルを得ることもできる。
三臭化リン(PBr3)による臭素化同様、副生成物として塩酸が生成するため、酸に弱い化合物の臭素化にはあまり向かない。こちらについても三臭化リンでの臭素化同様、氷冷した大過剰の塩基性溶液で素早く中和するなどの工夫である程度解決可能である。
また、反応では刺激臭を有する二酸化硫黄 (SO2)が副生するため、注意が必要である。

反応機構
反応機構は基本的にSNi反応と呼ばれる分子内求核置換反応で進行するとされ、立体的な変化は起こらない(本項①参照)が、ピリジンなどの塩基の存在下で反応を行うと、SN2反応が進行し、立体が反転する(本項②参照)。
①SNi反応
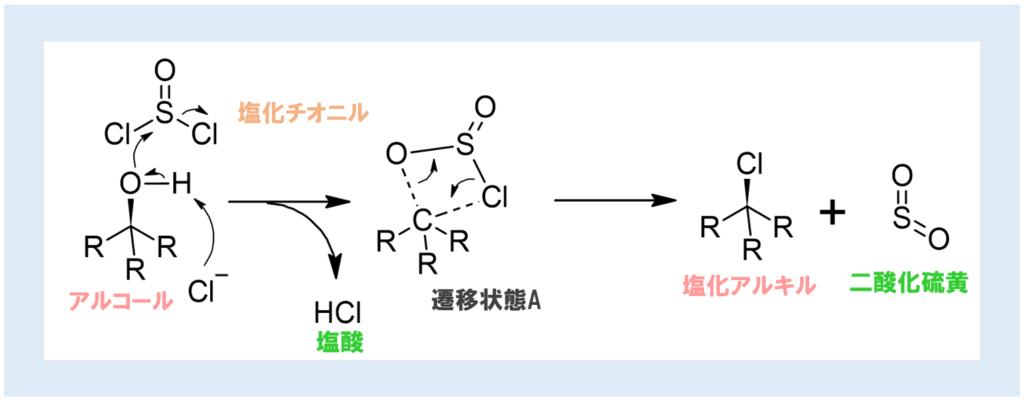
まず、OHが塩化チオニルに求核攻撃するとともに、塩化物イオンがOHのプロトンを攻撃して塩酸が脱離する。これによって、遷移状態Aのような四員環構造になるとされる。ここから分子内求核置換反応により、目的の塩化アルキルと二酸化硫黄が生成する。
②SN2反応
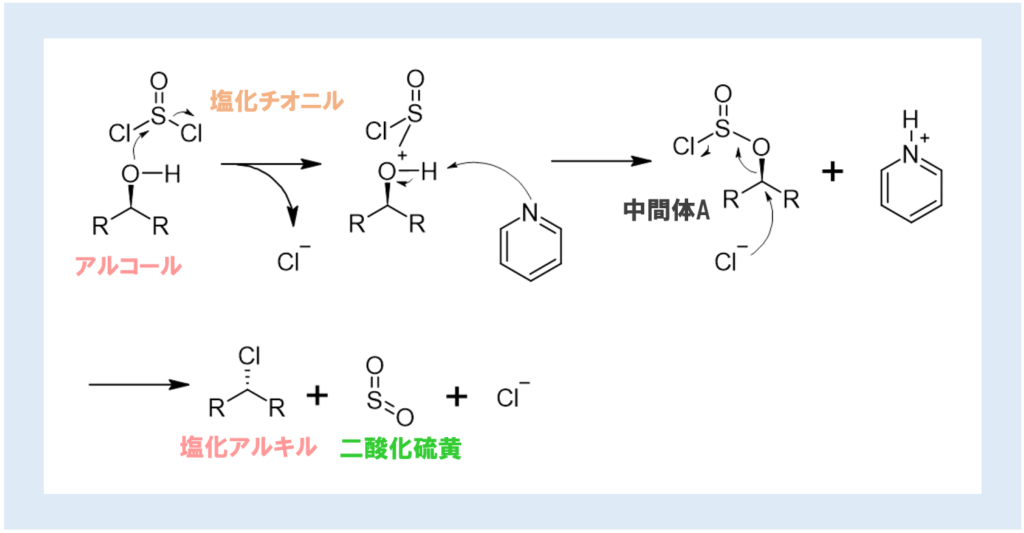
OHが塩化チオニルに求核攻撃し、その後塩基(ここではピリジン)がプロトンを奪い、中間体Aが生成する。ここに塩化物イオンが求核攻撃することで、立体が反転した塩化アルキルと、二酸化硫黄が生成する。
近年における使用例
①
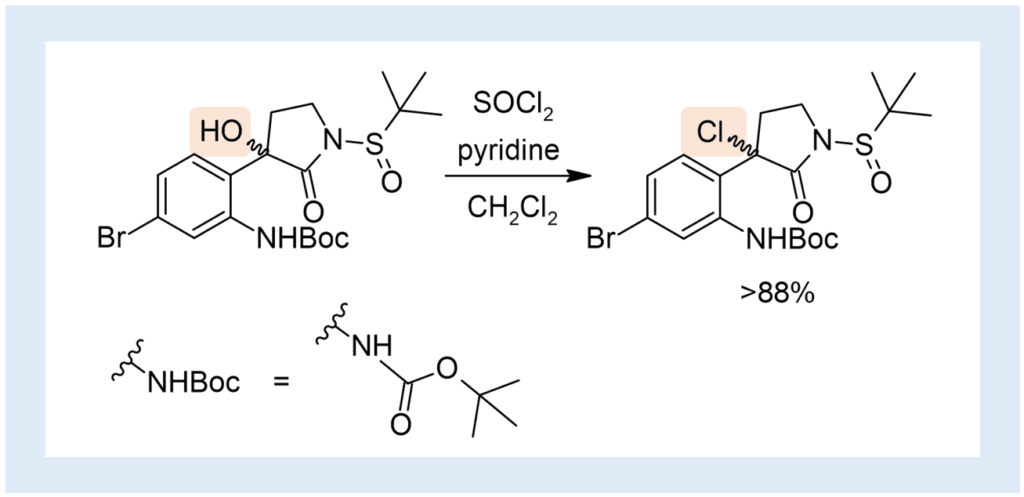
氷冷したジクロロメタンに溶解させた原料 114 mg (0.24 mmol)に対し、ピリジン 58 μl (0.72 mmol)を加え、5分攪拌した後、塩化チオニル 30μl (0.36 mmol)を滴下し、0℃を維持したまま10分攪拌した。これを水でクエンチした後、ジクロロメタンで抽出した。その後硫酸ナトリウムで脱水し、溶媒留去して目的物のクルードを得た。(文献中ではその後、2段階目の反応に使用している。この2ステップ全体の収率が88%)
②
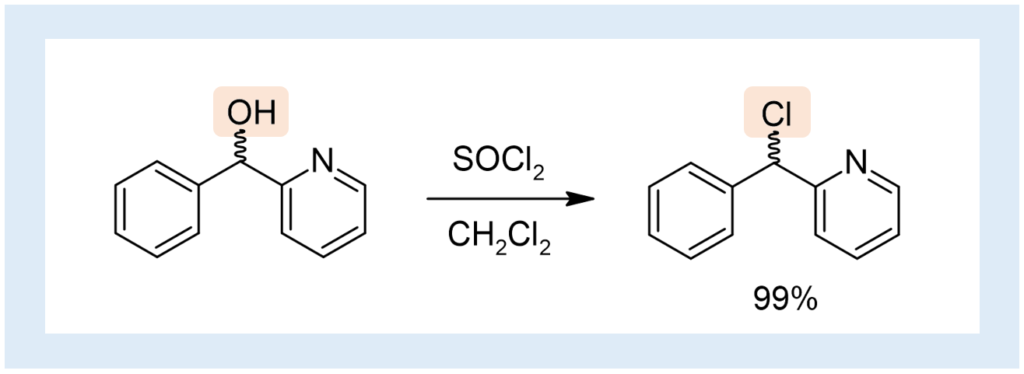
ジクロロメタン 3 mlに溶解させた原料 100 mg (0.540 mmol)に対し、塩化チオニル1 mlを加え、還流条件で16時間反応させた(二酸化硫黄の発生に注意)。反応溶液を氷冷した飽和炭酸カリウム水溶液 20 mlに加えてクエンチし、ジクロロメタンで抽出、硫酸マグネシウムで脱水した。その後、カラムで単離し、目的物を得た。
試薬価格
※下記は一例です。販売会社、時期、グレードなどによって価格は異なります。
SOCl2:500 ml /3,000円程度(CAS:7719-09-7)
参考文献
基本文献
J. Am. Chem. Soc. 1952, 74, 2, 308–311.
Bruice Paula Yurkanis, Organic Chemistry, 2013.
使用例
① J. Am. Chem. Soc. 2010, 132, 40, 14052–14054.
② J. Org. Chem. 2008, 73, 22, 9140–9143.